
全文速览
提升材料强氧化能力、构筑高活性表面是实现高效光催化抗菌的关键挑战。清华大学化学系朱永法课题组基于前期在光催化健康领域的研究成果(Angew. Chem. Int. Ed. 2025, 64, e202421356; JACS Au 2025, 5, 3500-3512; Natl. Sci. Rev. 2021, 8, nwaa155;Appl. Catal. B: Environ. 2018, 2231, 51-261等),进一步开发了一种具有给体-受体(D-A)结构的有机超分子光催化剂SA-PDI@C60, 实现自然光响应下的抗生素耐药菌(ARB)有效杀灭及抗生素耐药基因(ARGs)完全去除。利用静电自组装法将乙二胺功能化富勒烯(C60-EDA)吸附在超分子苝酰亚胺(SA-PDI)上,成功构建了具有D-A结构的超分子SA-PDI@C60。分子间极化诱导使得SA-PDI@C60的分子偶极增大,形成1.96倍增强的D-A界面电场,极大促进了电荷分离与迁移。一方面,光生电子从C60-EDA快速转移到SA-PDI,并沿着超分子SA-PDI的π-π堆积方向快速传输,加速了电荷迁移动力学;另一方面,高效的电荷分离进一步促进了材料表面的空穴积累,形成了多种ROS协同的强氧化高活性表面,大大提高了光催化的抗菌活性。SA-PDI@C60在可见光及自然光下均具有优异的广谱抗菌性能,并能不可逆地灭活ARGs。自然光下,SA-PDI@C60对大肠杆菌(E.coil)、金黄色葡萄球菌(S. aureus)和多种ARB在2 h内的灭活率均达到100%,并在4 h内实现对卡那霉素耐药基因(Kan-ARGs)的完全去除。这项工作不仅为构建高电荷分离效率和强氧化高活性界面的D-A光催化剂提供了可行性策略,而且为解决抗生素耐药污染问题开辟了新的视角。
背景介绍
对于人类生命健康而言,细菌感染是仅次于癌症的第二大威胁。随着抗生素的长期滥用,细菌逐渐进化出对抗生素药物具有耐药性的抗生素耐药菌(ARB),并通过抗生素抗性基因(ARGs)发生遗传或水平转移,这使得抗菌在生物医药、环境治理等领域面临着更严峻的挑战。光催化抗菌技术因其具有稳定高效、环境友好、无潜在耐药性及副作用等优势,被认为是一种新兴的理想抗菌策略。其主要通过半导体光催化剂在光激发下产生的活性氧物种(ROS)或其它有毒物质以攻破细菌膜,并进一步裂解耐药基因,使其彻底灭活。在此背景下,具有可见光乃至自然光响应、操作可控性、高生物安全性和强氧化能力的有机半导体抗菌剂,成为替代抗生素进行细菌杀灭的选择之一。
苝酰亚胺(PDI)具备规模化生产的成本效益、光电性能优异、分子结构可调等优势,被广泛应用于光催化能源转化、污染物降解、光动力治疗等领域。研究表明,通过氢键作用,疏水作用和π-π堆积形成的超分子自组装PDI(SA-PDI),存在独特的π电子共轭结构在一定程度上有助于光生载流子的传输,并增强光吸收的能力。然而,高激子结合能和低载流子迁移率导致较差的光生电荷分离和迁移效率,因此极大限制了其光催化活性。对此,本研究提出引入具有高电子离域、低复合能的乙二胺功能化富勒烯(C60-EDA)以调控电荷转移,通过构建D-A界面电场以促进光生载流子的高效分离与定向迁移。
研究亮点
(1)D-A效应增强内建电场,促进电荷分离:增大的分子偶极诱导产生了1.96倍增强的D-A界面内建电场(IEF),促进了高效电荷分离与定向迁移。
(2)强氧化活性抗菌表面构筑:C60-EDA的成功引入促进了材料表面对细菌膜的正电吸附;在IEF驱动下,强氧化h+有效迁移提升5.2倍,形成吸附和氧化协同的抗菌活性表面。
(3)自然光下生成大量ROS,高效灭活ARB并实现ARGs清除:多种活性氧组分(h+ > ·OH > 1O2 > ·O2⁻) 协同作用,引起脂质过氧化以破坏细菌细胞膜结构,显著干扰胞内代谢过程,从分子水平不可逆损伤ARGs、彻底阻遏其水平转移。
图文解析
如图1a所示,本研究通过两步组装法构建了D-A型超分子光催化剂SA-PDI@C60:首先通过pH调控驱动PDI分子自组装形成SA-PDI纳米纤维,随后通过静电吸附将C60-EDA负载于其表面形成复合结构。透射电镜(TEM,图1b)显示C60-EDA均匀分散于SA-PDI纳米纤维表面。高分辨TEM(图1c)证实二者形成紧密结合的异质结界面,SA-PDI和C60-EDA的晶格间距分别为0.32 nm和0.21 nm,表现出高结晶性和利于电荷分离的结构特征。X射线衍射(图1d)在25°附近出现π-π堆积特征峰,证实了有序超分子结构的存在。紫外-可见光谱(图S2)表明SA-PDI呈H型堆积模式,C60-EDA的引入进一步强化了H型堆积,增强了分子间π-π相互作用,促进电子离域和电荷迁移。X射线光电子能谱(XPS,图S3)和傅里叶变换红外光谱(FT-IR,图S4)证实了SA-PDI与C60-EDA间的静电作用。C60-EDA表面氨基中和了SA-PDI的负电荷,使复合物Zeta电位转为+5.5 mV(图S5),有利于通过静电作用吸附带负电的细菌细胞膜,进而促进光催化灭菌进程。
为阐明界面电子结构,采用密度泛函理论(DFT)计算研究了D-A界面基态电子分布。最高占据分子轨道(HOMO)的电子密度主要分布于C60-EDA区域,而最低未占据空轨道(LUMO)则集中于SA-PDI(图1e),表明该界面结构为光生电子从C60-EDA向SA-PDI迁移提供了潜在路径。紫外-可见漫反射光谱(DRS,图1f)进一步提供了电荷转移的证据:在730 nm处出现新的吸收带,归属于分子间电荷转移(CT)跃迁,证实了D-A界面的成功构建。与SA-PDI相比,SA-PDI@C60在太阳光谱范围内吸收更宽,有利于在光催化应用中利用可见光及自然光(图1f)。基于以上结果,提出了D-A界面的结构模型(图1g):在光激发下,电子从C60-EDA转移至SA-PDI,并沿π-π堆叠的SA-PDI纳米结构迁移;同时,光生空穴(h+)在材料表面累积,形成强氧化性界面,对光催化灭菌及抗性基因降解起关键作用。
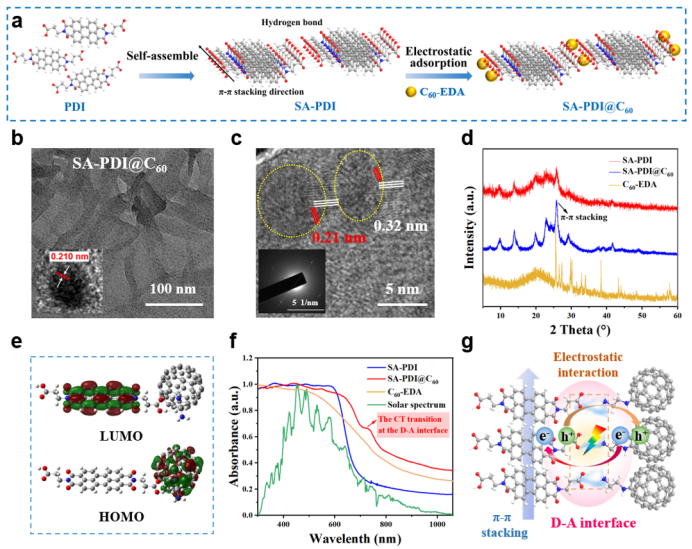
图1. D-A超分子SA-PDI@C60的制备流程和形貌结构表征
通过静电相互作用构建的D-A界面在产生界面内建电场(IEF)方面起到关键作用,可有效促进电荷分离与迁移。如图2a所示,SA-PDI电荷分布较为均匀,而SA-PDI@C60则呈现明显的界面电位差,表明其分子偶极矩增强,形成了从SA-PDI指向C60-EDA的定向IEF。IEF定量分析(图S6)表明,SA-PDI@C60中IEF强度为SA-PDI的1.96倍(图2b),证实D-A结构可显著增强IEF。能带结构分析(图S7)和功函数测试(图S8)进一步明确了界面电荷转移路径(图2c):在IEF驱动下,SA-PDI能带上弯,C60-EDA能带下弯,电子自发由C60-EDA向SA-PDI迁移直至费米能级平衡,为D-A结构建立了能量基础。
增强的IEF作为内建驱动力,显著提高了电荷分离与迁移效率。KPFM表面电位测试(图2d)显示,SA-PDI@C60表面电位为90 mV,较SA-PDI(60 mV,图S9)提高1.5倍,表明IEF有效促进了电荷分离。光电化学测试中,SA-PDI@C60光电流密度(3.5 μA cm-2)显著高于SA-PDI(1.5 μA cm-2)(图2e),直接证明IEF增强了电荷分离效率。荧光发射光谱显示(图2f),SA-PDI在700 nm处存在明显发射峰,而SA-PDI@C60荧光强度显著降低,表明空穴-电子对复合受到有效抑制,提高了光生电荷利用率。
电化学阻抗谱(EIS,图2g)中SA-PDI@C60弧径更小,电荷转移电阻低于SA-PDI,说明IEF改善了载流子转移动力学。表面光电压(SPV)测试表明(图2h),二者在400–650 nm均呈现正信号,说明光生空穴为主要载流子并扩散至表面空间电荷区; SA-PDI@C60的SPV响应更强,反映其空穴迁移效率更高。CLSM荧光定量分析进一步显示(图2i),SA-PDI@C60中光生空穴的强度与数量显著高于SA-PDI,证实D-A界面不仅促进电荷分离,更利于空穴在催化剂表面积累。这种带正电且富空穴的表面极大促进了光催化氧化反应,从而赋予材料优异的抗菌性能。
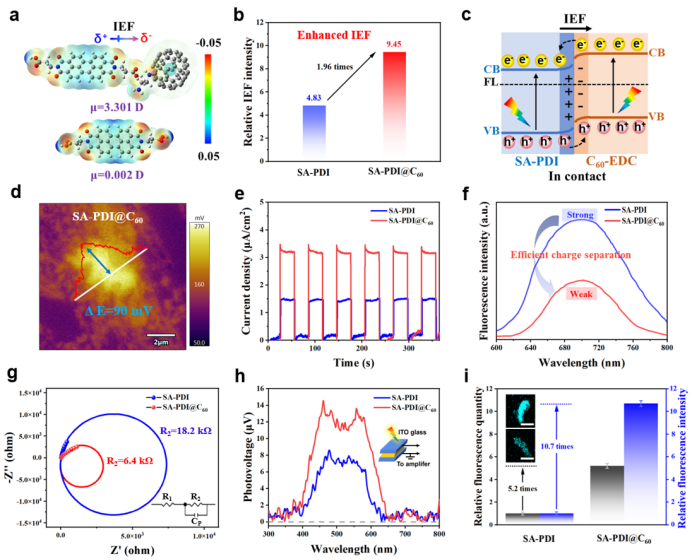
图2. 增强的界面电场促进光生载流子高效分离与定向迁移
SA-PDI@C60凭借其表面正电荷特性,可在黑暗条件下高效吸附细菌,为后续光催化氧化过程提供基础。在可见光(100 mW cm-2)辐照下,SA-PDI@C60表现出优于单一组分的抗菌性能,证实了D-A结构设计的优越性。在0.2 mg mL-1浓度下,可在90 min内完全灭活S. aureus(图3a),并四轮循环实验保持结构和性能稳定性。电镜形态观察显示菌体严重变形破裂(图3b),脂质过氧化分析表明其通过氧化降解细胞壁中不饱和C=C键实现破坏。
基于其广谱光吸收特性,SA-PDI@C60在两种可见光和自然光下均表现出优异的抗菌性能(图3c)。此外,其对革兰氏阴性菌(如E. coli)和多种抗生素耐药菌(包括MRSA和PA等)均具备广谱杀菌效果:自然光下1小时内对ARB的灭活率超过95%(图3d)。以携带卡那霉素抗性基因的E. coli (Kan R)为模型,自然光照射3小时后,ARGs绝对丰度降至5.80 lg10 拷贝 μL-1,较SA-PDI提升4.3倍(图3e)。琼脂糖电泳(图3f)显示PCR扩增产物条带随光照时间逐渐消失,4小时后完全不可检出,表明ARGs被彻底破坏为小分子片段。转化实验(图3g)进一步证实,照射4小时后无转化子生成,证明其有效阻断了基因水平转移。此外,SA-PDI@C60在自然光条件和实际废水体系中仍保持优良的灭菌性能与稳定性,证明其在真实环境中的科学应用潜力。
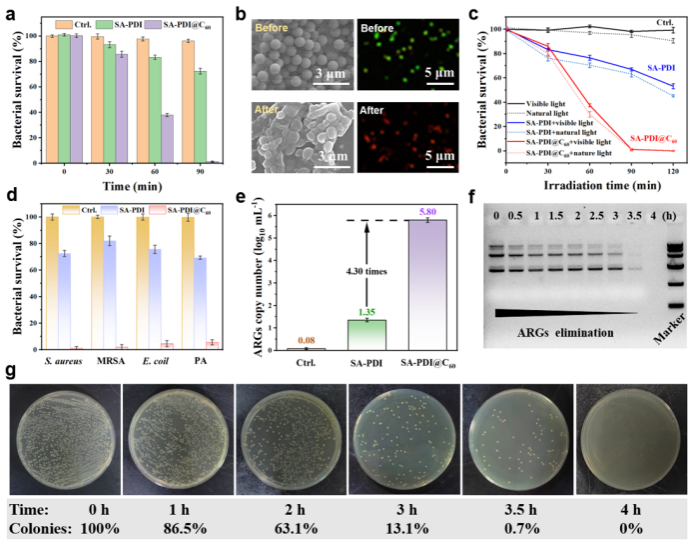
图3. 可见光及自然光响应的光催化杀菌及抗生素耐药基因去除
ARGs 消灭过程始于ROS攻击细菌细胞膜的脂质成分,破坏膜的完整性并导致细胞质泄漏。随后,ROS穿透细胞并造成氧化性的 DNA 损伤,包括碱基损伤和糖苷键断裂等。进一步触发 DNA 链的非特异性断裂,最终导致 ARG 的不可逆灭活和降解。电子自旋共振(ESR)谱图(图 4a)显示,在可见光照射下生成了多种 ROS 的明显信号;自由基捕获和动力学分析证实了活性物质的相对贡献顺序为h+ > ·OH > 1O2 > ·O2⁻(图 4a)。对此,提出了一种涉及多ROS 协同光催化机制(图 4c):在可见光或自然光的激发下,e-从 C60-EDA高效地转移到 SA-PDI,实现电荷分离,并促进 SA-PDI 表面积累h+。这些强氧化h+直接将水氧化生成·OH,而电子则将溶解的O2还原为·O2⁻,随后生成1O2。h+、·OH、·O2⁻和1O2的共存及相互作用形成了一个多活性氧物质协同光催化途径,合理解释了 SA-PDI@C60强效杀菌及其ARGs 降解性能。
为了阐明 SA-PDI@C60的光催化杀菌生物学机制,进行了蛋白质组学分析。如图 4d-e 所示,显著积累的ROS,破坏了有氧呼吸和氧化还原平衡,最终通过五个主要途径导致细菌死亡:
(1)抑制DNA复制和细胞增殖。参与 DNA 复制的关键蛋白质,包括 dnaX 及其相关的聚合酶成分,显著下调,这表明光催化过程有效地抑制了细菌的增殖。
(2)抑制 ATP 生成和氧化磷酸化。用于 ATP 生成的蛋白质,如 ATP 合酶(atpA)和电子传递链的成分(例如 sdhC),显著下调,表明在氧化应激条件下能量生成受到抑制。
(3)三羧酸循环的破坏。像苹果酸脱氢酶(mdh)、琥珀酸脱氢酶(sdhE)和富马酸酶(fumA)这样的核心代谢酶的表达水平下降,这表明代谢通量受损,细胞能量输出减少。
(4)糖酵解和糖异生的补偿性激活。面对呼吸作用受损的情况,大肠杆菌转向了无氧代谢。包括醛缩酶(aldA)、磷酸烯醇式丙酮酸合酶(ppsA)和醇脱氢酶(adhP)在内的糖酵解和糖异生酶被上调,以维持基本的能量需求并减轻氧化还原应激。
(5)抗氧化防御系统的诱导。谷胱甘肽还原酶(gor)和 BtuE 蛋白显著上调,表明谷胱甘肽循环增强以及对 ROS 诱导的氧化损伤的抗氧化反应增强。氧化还原调节蛋白 ybgK 的进一步上调。
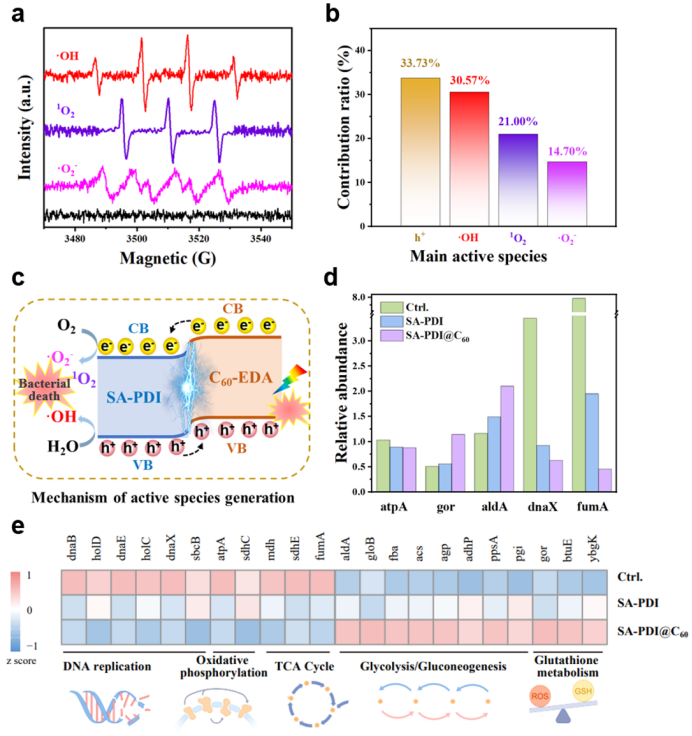
图4. 多ROS协同的光催化杀菌机制
根据上述结果,提出了 D-A 超分子 SA-PDI@C60的光催化抗菌增强机制(图 5)。C60-EDA静电组装吸附于SA-PDI 表面,从而形成分子间 D-A 结构。SA-PDI@C60中不均匀的电荷分布导致从 SA-PDI 到C60-EDA 的强大内电场,极大地促进了电荷的分离和迁移。光激发下,C60-EDA产生的光生电子被转移到 SA-PDI上,并沿着 SA-PDI 的独特 π-π 堆叠方向迅速迁移。该过程进一步导致表面积累强氧化性的h+,并协同多种ROS有效抑制 ARB、实现ARGs完全去除。
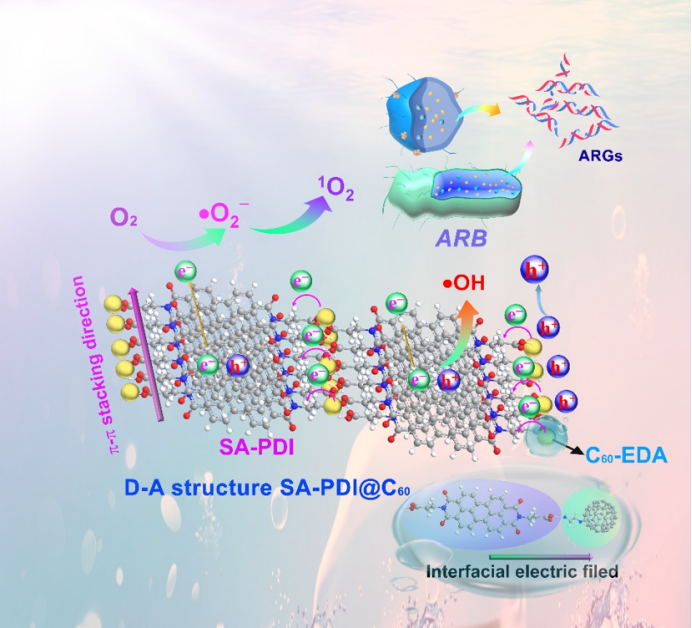
图5. D-A界面电场促进光催化杀菌的机理图
总结与展望
该研究设计了一种具有强氧化活性D-A界面的超分子光催化剂SA-PDI@C60,用于在自然光下高效杀菌和ARGs去除。D-A相互作用促进了电荷从C60-EDA向SA-PDI的转移,产生了比SA-PDI更大的分子偶极矩,从而建立了1.96倍增强的界面电场,促进了光生载流子的分离。光生电子(e-)沿SA-PDI特有的π-π堆积方向快速迁移,而光生空穴(h+)在表面转移积累。由于SA-PDI表面的e-还原O2生成·O2-和1O2,累积的h+进一步氧化H2O生成·OH,从而形成多活性物种协同作用的光催化杀菌机制。因此,SA-PDI@C60在阳光下对大肠杆菌和金黄色葡萄球菌的失活率均达到100%(分别在2 h和1.5 h内)。此外,其可在2 h内完全杀死ARB,并在4 h内灭活100%的Kan-ARGs,从而彻底阻断了水平基因转移途径。通过蛋白质组学分析进一步揭示,活性氧所引发的氧化应激严重破坏了细菌的DNA复制、有氧呼吸及能量代谢过程,最终导致细菌死亡。该研究开发了一种具有高活性界面和高效电荷分离特性的D-A光催化剂,在自然光驱动下实现高效细菌灭活及抗生素耐药基因去除,拓展了有机超分子在环境光催化杀菌领域的科学应用。
文章信息
Wenting Li1, Wenlu Li1, Xiaolin Zhu*, Yizhou Yan, Haoying Wang, Wenhao Shi, Jun Yang, Zhaohui Wu, Lijuan Li, Jinhan Sheng, Ming Wang, Yongfa Zhu*, Highly efficient photocatalytic elimination of bacteria and antibiotic resistance genes via a strong oxidation surface in donor-acceptor SA-PDI@C60,Adv. Funct. Mater., 2025, e17661.
http://doi.org/10.1002/adfm.202517661
作者介绍
第一作者:李汶亭,本科、硕士、博士分别毕业于中南民族大学、中国科学院化学研究所、清华大学。主要从事光催化环境与健康应用研究,开发设计了一系列高活性的有机半导体光催化剂,实现可见光催化有机污染物高效降解、自然光杀菌及抗生素耐药基因去除、近红外光催化肿瘤治疗。目前,以第一作者或共同通讯作者身份在Angew. Chem. Int. Ed.; Adv. Funct. Mater. (2); Appl. Catal. B: Environ. (3); JACS Au等高水平国际期刊发表SCI论文11篇,共发表学术论文20篇,H-index为8,已获授权专利2项,指导大学生创业训练项目1项(国家级)。担任Appl. Catal. B: Environ.; Phys. Chem. Chem. Phys.等学术期刊的审稿人。
第一作者:李文璐,北京工商大学讲师。本科、博士毕业于清华大学化学系。主要从事食品风味化学及光催化抗菌与食品保鲜研究。主持国家自然科学基金青年项目,重点研究计划子课题等项目,目前,在Angew. Chem. Int. Ed.; Adv. Mater.;Adv. Funct. Mater.; Appl. Catal. B: Environ.等高水平国际期刊发表SCI论文20余篇,高被引论文7篇,H-index为21。担任Appl. Catal. B: Environ.; Food Chem.等学术期刊的审稿人。
通讯作者:朱晓林,陕西师范大学化学化工学院副研究员。本科、博士毕业于南京工业大学,先后在美国从事5年博士后/访问学者研究工作。朱博士主要从事有机光功能材料的设计合成、超分子自组装及其在可见光催化的应用研究。朱博士长期从事功能表界面化学研究,聚焦光功能材料分子设计、超分子可控组装及表界面调控机制研究。近年来,主持国家自然科学基金青年项目、陕西省自然科学基金青年项目、中国博士后科学基金、陕西省基础科学(化学、生物)研究院项目等基金项目。在J. Am. Chem. Soc.; Angew. Chem. Int. Ed.; Nat. Commun.; JACS Au; Sci. Bull.; Coor. Chem. Rev.; Chem. Sci.;Adv. Funct. Mater. 等学术期刊上发表论文60余篇,单篇最高引用430余次,论文累计引用2500余次,H指数为25。担任eScience; Green Carbon; Science for Energy and Environment等期刊的青年编委。担任Sci. Adv.; Angew. Chem.; Adv. Sci.; ACS Nano; Chem. Sci.; J. Phys. Chem. Lett.等学术期刊的审稿人。
朱晓林课题组网站:https://www.x-mol.com/groups/xiaolinzhu
通讯作者:朱永法,清华大学化学系教授、博导,国家杰出青年科学基金获得者,国家电子能谱中心常务副主任。分别获得南京大学、北京大学和清华大学的学士、硕士和博士学位,并于日本爱媛大学从事博士后研究。1988年7月起在清华大学化学系工作,主要研究方向为能源光催化、环境光催化及光催化健康,主持多项国家973项目、863项目、国家自然科学基金重点、国家自然科学基金仪器专项、国际重点合作项目和面上项目等基础研究课题,获得国家自然科学奖二等奖1项,教育部自然科学奖一等奖2项、二等奖1项,教育部科技进步奖二等奖和三等奖各1次。以第一/通讯作者在Nature Energy(1), Nature Catalysis(2),Nature Communication(5),Angewandte Chemie International Edition(18),Chem(3), Advanced Materials(13),Energy and Environmental Science(3),Environmental Science and Technology(10)等国内外重要学术刊物上发表论文650篇,论文被引用超过60146次,H-index为137,50余篇论文被《基本科学指标》评选为ESI 1%高被引论文。2014-至今,Elsevier高被引学者(化学);2018-至今,科睿唯安“全球高被引科学家”(化学),2021和2023年度全球前10万顶尖科学家排名分别第851位和1343位,中国顶尖科学家排名第62位。学术兼职有Science for Energy and Environment(SEE)创刊主编,Applied Catalysis B 副主编,Green Carbon副主编。中国感光学会副理事长兼光催化专业委员会主任;北京市室内与车内环境净化行业协会会长;中国分析测试协会常务理事;中国化学会环境化学专业委员会委员;环境与能源光催化国家重点实验室学术委员会委员;教育部资源化学重点实验室学术委员会副主任;核生化灾害防治全国重点实验室学术委员会委员;太阳能光电转化与利用全国重点实验室学术委员会委员。
朱永法课题组网站:https://www.yfzhugroup.com/
资讯来源:微信公众号”邃瞳科学云“推文《清华大学朱永法团队AFM:强氧化活性D-A超分子SA-PDI@C60实现自然光催化杀菌及抗生素耐药基因去除》
阅读推文
阅读原文